Сверхмалые дозы биологически активных веществ: закономерности и механизмы действия (биохимические основы гомеопатии)
Гуревич К.Г.
Введение
Впервые врачевание малыми дозами было предложено в 1790 г. Самуилом Ганеманом. Он же предложил принцип ‘similia similibus curantur’ (‘подобное лечится подобным’), благодаря которому его метод получил названия гомеопатии (гр.: homoios- подобный, pathos- страдание). С развитием медицины и фармакологии в ХХ в, казалось бы, канула в прошлое гомеопатическая школа. Невоспроизводимость результатов, нестабильность эффектов лечения, невозможность их объяснения с научной точки зрения,- вот основные недостатки гомеопатии. Однако, в последние годы стал наблюдаться возрастающий интерес исследователей к действию сверхмалых доз биологически активных веществ. Например в базе данных MEDLINE за период с 1994 г. по начало 2000 г., можно найти более 1200 ссылок на публикации, посвященные действию сверхмалых доз и их эффектам. Данные эффекты описаны для разнообразных групп биологически активных веществ: гормонов, эндогенных регуляторных пептидов, некоторых непетидных веществ и т.д.
При этом следует отметить, что общепринятого определения сверхмалых доз нет - и различные авторы указывают разные цифры. Зачастую никаких обоснований авторами не приводится; кроме того, многие авторы путают понятия "доза" и "концентрация". В частности, в работе [1] под сверхмалыми дозами понимаются концентрации бруфена, более низкие, чем описанные ранее в литературе (10-10- 10-14 М). Согласно Бурлаковой Е.Б. и соавт. (1990), под сверхмалыми дозами понимаются концентрации биологически активных веществ ниже 10-12 М [2], при этом никаких обоснований для такого определения сверхмалых доз не приводится. По определению Сазанова Л.А. и Зайцева С.В. (1992) сверхмалыми дозами считаются концентрации в диапазоне 10-18 - 10-14 М, т.к. при этом наблюдается связывание единичных молекул лиганда с рецепторами [3].
С нашей точки зрения, правильней понимать под сверхмалыми дозы, обеспечивающие концентрацию биологически активного вещества (БАВ) в месте действия на несколько порядков ниже константы диссоциации БАВ с эффектором (обычно константа диссоциации для рецепторов составляет порядка 10-9-10-12 М, с ферментом —10-5-10-7 М [4]). Однако, необходимо оговориться, что при концентрациях ниже 10-20 М вероятность нахождения хотя бы одной молекулы БАВ в 1 мл жидкости близка к нулю, поэтому для объяснения подобных эффектов авторы используют такие понятия как "активированная вода", "память молекул" [5, 6], "биоактивация" [7], а мы не будем их рассматривать, так как они лишены физического смысла.
Если сверхмалые дозы оказывают достоверное воздействие на биологический объект, то они являются действующими дозами. Если сверхмалые дозы на биологические объекты не влияют, то их изучение не имеет смысла. В этой связи выделение сверхмалых доз необходимо только по отношению к взаимодействию лигандов с рецепторами: если взаимодействуют единичные молекулы лиганда с рецепторами, то лиганд-рецепторное взаимодействие носит вероятностный характер и наблюдаются случайные флуктуации количеств связанного с рецепторами лиганда (данный вопрос подробней рассматривается ниже).
Действительно, доказано, что биологические эффекты могут вызываться единичными молекулами (обзоры: [2, 3]). В частности, в работе [8] показано сохранение биологических эффектов ферромона при разбавлении до 36 молекул в 1 мкл.
Поэтому исследование действия сверхмалых доз веществ представляет значительный интерес, т.к. может привести к созданию новых лекарственных веществ или к описанию новых, существенно важных, свойств уже известных БАВ. Кроме того, изучение действия сверхмалых доз биологически активных веществ может помочь объяснить эффекты ряда гомеопатических препаратов.
Закономерности действия сверхмалых доз
При анализе данных литературы, посвященных действию сверхмалых доз, обращает на себя внимание отсутствие эффектов в области концентраций 10-12-10-8 М (так называемая "мертвая зона"). Традиционно, изучая действие различных БАВ, фармакологи не находили их эффектов при достаточно низких концентрациях и считали, что при еще более низких концентрациях их эффектов заведомо не будет. Однако, в настоящее время показано обратное: при действии сверхмалых доз могут наблюдаться достоверные эффекты на биологические объекты; при этом данные эффекты могут отличаться от обнаруженных при действии более больших доз, а могут совпадать с ними. Следовательно, необходимо изучение эффектов БАВ во всем диапазоне концентраций: от атомарных до молярных. Отсутствие эффекта при достижении "достаточно больших" (или "достаточно низких") концентрациях не означает его отсутствия при действии еще более больших (более низких) концентрациях.
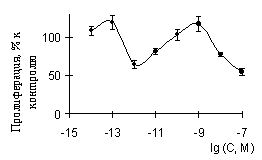
Для многих веществ было показано, что эффекты сверхмалых доз примерно совпадают по силе и величине с наблюдаемыми при действии более больших. При этом кривая "доза-эффект" имеет бимодальный характер. В частности такие данные представлены на рис. 1 по работе [9].
С другой стороны, эффекты сверхмалых доз нестабильны. Многие авторы расценивают действие сверхмалых доз как парадоксальное, потому что эффекты наблюдаются в области концентраций, которые на несколько порядков меньше константы связывания лигандов с рецепторами. Многие эксперименты оказываются невопроизводимыми и в одних и тех же условиях эффекты сверхмалых доз могут различаться не только по силе, но и по знаку [2, 3]. Это дает основание многим авторам сомневаться в достоверности эффектов сверхмалых доз биологически активных веществ.
|
Рисунок 1. Влияние простагландина Е2 на пролиферацию лимфоцитов селезенки мыши [9]. |
В доступной литературе до сих пор нет теории, которая бы полностью объясняла все эффекты действия сверхмалых доз биологически активных веществ. Наблюдаемые эффекты пытаются объяснить при помощи следующих гипотез: концентрирование лекарственного вещества, наличие высокоэффективных систем проведения и усиления рецепторного сигнала, "адаптации" рецепторов к действию сверхмалых доз [3], существование супервысокоаффинных рецепторов [2].
Молекулярные механизмы действия сверхмалых доз БАВ
С нашей точки зрения, наиболее вероятным объяснением эффектов сверхмалых доз биологически активных веществ представляется существование высокоэффективных систем проведения и усиления рецепторного сигнала. Действительно, один G-белок сопряженный рецептор, находясь в активном состоянии, может взаимодействовать с 10–100 G-белками. G-белок способен проактивировать 10-100 аденилатциклаз. Одна активная аденилатциклаза способна катализировать образование до 1000 молекул цАМФ. Тем самым рецепторный сигнал может быть усилен в 106–1010 раз [4, 10]. Заметим, что еще более мощные системы усиления сигнала наблюдаются для другого внутриклеточного мессенджера, ионов кальция [10]. Существование столь мощных систем проведения и усиления рецепторного сигнала способно объяснить действие сверхмалых доз биологически активных веществ.
Таким образом, биологический ответ может быть получен при оккупации незначительной части рецепторов. Данное предположение перекликается с "классической" теорией "свободных рецепторов" Стефенсона [11], согласно которой максимальный эффект агонистов наблюдается при оккупации части рецепторов. Тем самым рассуждения, приведенные выше, дают обоснование теории Стефенсона исходя из современных представлений о молекулярных механизмах проведения и усиления рецепторного сигнала.
|
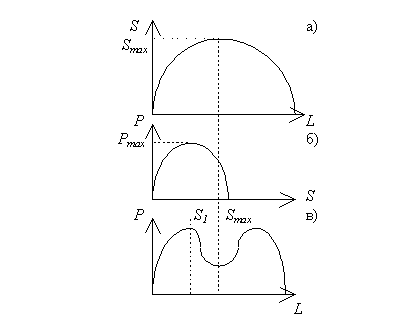
Рисунок 2. Возможное объяснение формирования полимодальной зависимости "доза-эффект" (комментарии в тексте).
|
Объяснение нестабильности эффектов сверхмалых доз
Основной проблемой, возникающей при изучении закономерностей действия сверхмалых доз биологически активных веществ и требующей своего объяснения, является нестабильность эффектов, невоспроизводимость результатов экспериментов со сверхмалыми дозами. С нашей точки зрения, их можно было бы объяснить исходя из следующих представлений.
Эффекты сверхмалых доз индуцируются связыванием единичных молекул лигандов с клеточными рецепторами. В этих условиях понятие "концентрация" лишено физического смысла, т.к. речь идет о случайном распределении единичных молекул в некотором объеме.
Кроме
того, в условиях связывания единичных молекул лиганда с рецепторами
лиганд-рецепторное взаимодействие описывается законом редких событий (Пуассона)
с математическим ожиданием ![]() (число лиганд-рецепторных комплексов)
и среднеквадратичным отклонением
(число лиганд-рецепторных комплексов)
и среднеквадратичным отклонением ![]() [12]. Это означает, что наблюдаются
случайные флуктуации числа связанных с рецепторами лигандов порядка
[12]. Это означает, что наблюдаются
случайные флуктуации числа связанных с рецепторами лигандов порядка ![]() . В этом случае
принципиальным становится получение критерия, по которому можно было бы рассматривать
данные флуктуации как случайные или неслучайные.
. В этом случае
принципиальным становится получение критерия, по которому можно было бы рассматривать
данные флуктуации как случайные или неслучайные.
Флуктуации
числа лиганд-рецепторных комплексов при действии сверхмалых доз были получены
во многих экспериментах и суммированы в обзорах [2, 3]. При увеличении числа
лиганд-рецепторных комплексов величина ![]() убывает - и при
убывает - и при ![]() лиганд-рецепторное взаимодействие
может быть описано исходя из закона действующих масс (т.к. дисперсия числа
лиганд-рецепторных комплексов становится мала по сравнению с их математическим
ожиданием).
лиганд-рецепторное взаимодействие
может быть описано исходя из закона действующих масс (т.к. дисперсия числа
лиганд-рецепторных комплексов становится мала по сравнению с их математическим
ожиданием).
По
всей видимости, случайные флуктуации порядка ![]() наблюдаются не только для системы
"лиганд-рецептор", но и для систем проведения и усиления рецепторного
сигнала, что приводит к увеличению величины случайных флуктуаций. К примеру,
если предположить, что в среднем связывается 10 лигандов с клеточными
рецепторами, то число лиганд рецепторных комплексов будет флуктуировать от 7 до
13. Если при этом каждый лиганд-рецепторный комплекс взаимодействует в среднем
с 10 G-белками, то число активных G-белков будет флуктуировать от 49 до 169.
Если каждый G-белок активирует в среднем 10 аденилатциклаз,
то число аденилатциклаз будет флуктуировать от 343 до 2197. Если каждая
аденилатциклаза синтезирует в среднем 100 молекул цАМФ, то число
синтезированных молекул цАМФ будет флуктуировать от 30,9 тыс. до 241,7 тыс.,
т.е., измеряемая в одном и том же эксперименте концентрация цАМФ может отличаться
примерно в 6 раз за счет случайных флуктуаций.
наблюдаются не только для системы
"лиганд-рецептор", но и для систем проведения и усиления рецепторного
сигнала, что приводит к увеличению величины случайных флуктуаций. К примеру,
если предположить, что в среднем связывается 10 лигандов с клеточными
рецепторами, то число лиганд рецепторных комплексов будет флуктуировать от 7 до
13. Если при этом каждый лиганд-рецепторный комплекс взаимодействует в среднем
с 10 G-белками, то число активных G-белков будет флуктуировать от 49 до 169.
Если каждый G-белок активирует в среднем 10 аденилатциклаз,
то число аденилатциклаз будет флуктуировать от 343 до 2197. Если каждая
аденилатциклаза синтезирует в среднем 100 молекул цАМФ, то число
синтезированных молекул цАМФ будет флуктуировать от 30,9 тыс. до 241,7 тыс.,
т.е., измеряемая в одном и том же эксперименте концентрация цАМФ может отличаться
примерно в 6 раз за счет случайных флуктуаций.
Таким образом, можно ожидать, что с развитием вероятностных представлений о механизмах лиганд-рецепторного взаимодействия будут получены новые данные для объяснения эффектов действия сверхмалых доз биологически активных веществ.
Механизм формирования "мертвой зоны"
Одной из необъясненных закономерностей эффектов действия сверхмалых доз является отсутствие биологического ответа в области 10-12-10-8 М [3], наблюдаемое практически во всех экспериментальных работах. При этом чаще всего кривые "доза-эффект" имеют полимодальный характер (см. рис. 1). С нашей точки зрения, объяснение этому феномену может быть дано исходя из предположения о существовании систем с отрицательной обратной связью, например, с субстратным торможением. На кривых доза-эффект для таких систем наблюдается максимум. К примеру, на рис. 2 а приведены кривые "доза эффект" для схемы:
![]() , (1)
, (1)
где
![]() - высоко-
и низко- аффинные рецепторы,
- высоко-
и низко- аффинные рецепторы, ![]() - лиганд,
- лиганд, ![]() - лиганд-рецепторные комплексы
с соответствующими рецептоами.
- лиганд-рецепторные комплексы
с соответствующими рецептоами.
На
кривой "доза-эффект" для схемы (1) наблюдается максимум (рис. 2 а)
с максимальным синтезом субстрата, ![]() . Субстрат S может вступать в процесс ферментативных превращений. При
этом, если кинетическая схема ферментативного превращения описывается следующим
образом (субстратное угнетение):
. Субстрат S может вступать в процесс ферментативных превращений. При
этом, если кинетическая схема ферментативного превращения описывается следующим
образом (субстратное угнетение):
![]() , (2)
, (2)
то
на кривой "доза-эффект" для схемы (2) будет максимум (рис. 2 б).
При этом на схеме (2): ![]() -фермент,
-фермент, ![]() - активные и неактивные
фермент-субстратные комплексы,
- активные и неактивные
фермент-субстратные комплексы, ![]() - продукт.
- продукт.
Пусть
максимальный синтез продукта, ![]() , наблюдается при концентрации
субстрата
, наблюдается при концентрации
субстрата ![]() .
Если точка максимума кривой "доза-эффект" схемы (2) приходится на
возрастающий участок схемы (1) (
.
Если точка максимума кривой "доза-эффект" схемы (2) приходится на
возрастающий участок схемы (1) (![]() ), то суммарная кривая
"доза-эффект" будет иметь полимодальный характер (рис. 2 в).
), то суммарная кривая
"доза-эффект" будет иметь полимодальный характер (рис. 2 в).
Если
синтез субстрата ![]() подчиняется
схемой (1), то, исходя из уравнений кинетики лиганд-рецепторного взаимодействия
[4] в условиях равновесия количество субстрата по формуле:
подчиняется
схемой (1), то, исходя из уравнений кинетики лиганд-рецепторного взаимодействия
[4] в условиях равновесия количество субстрата по формуле:
![]() (3)
(3)
где
![]() -
начальные концентрации рецепторов,
-
начальные концентрации рецепторов, ![]() -концентрация лиганда (
-концентрация лиганда (![]() ),
), ![]() -константы
диссоциации лигандов с рецепторами,
-константы
диссоциации лигандов с рецепторами, ![]() - коэффициенты, учитывающие вклад
каждого из рецепторов в активацию или угнетение синтеза субстрата.
- коэффициенты, учитывающие вклад
каждого из рецепторов в активацию или угнетение синтеза субстрата.
"Мертвой" зоне на суммарной кривой "доза-эффект" (рис. 2. в) соответствует точка максимума на кривой "доза-эффект" для уравнения (3) (рис. 2 а), которая наблюдается при концентрации лиганда, удовлетворяющей тождеству:
![]() (4)
(4)
Если
![]() , то при
концентрации лиганда
, то при
концентрации лиганда
![]() (5)
(5)
наблюдается
максимальный синтез субстрата, ![]() .
.
Так как "мертвая" зона находится в диапазоне концентраций 10-8-10-12 М, то, как следует из проведенных рассуждений и условия (5), константы диссоциации лигандов с рецепторами должны иметь порядок 10-8-10-12 М, что действительно наблюдается для реальных рецепторных систем [4].
Развитие эффектов сверхмалых доз во времени
Системы
с обратной связью могут позволить получить еще одно очень интересное следствие.
Пусть синтез субстрата ![]() определяется схемой (1) и формулой
(3) при
определяется схемой (1) и формулой
(3) при ![]() ,
а концентрация лиганда изменяется в соответствии с кинетикой однокамерной
фармакокинетической модели [4]:
,
а концентрация лиганда изменяется в соответствии с кинетикой однокамерной
фармакокинетической модели [4]:
![]() (6)
(6)
где
![]() -
эффективная доза БАВ (поступающая в камеру),
-
эффективная доза БАВ (поступающая в камеру), ![]() - объем камеры,
- объем камеры, ![]() - константа элиминации,
- константа элиминации, ![]() - константа
скорости поступления БАВ в камеру.
- константа
скорости поступления БАВ в камеру.
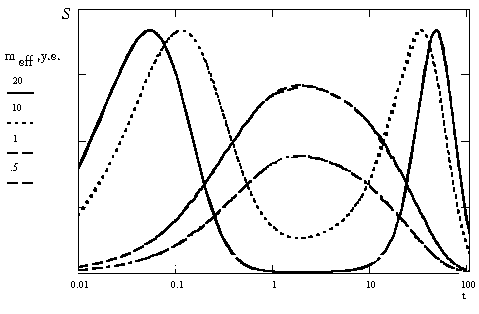
Исходя из изложенных предположений могут наблюдаться моно- или бимодальные временные зависимости "доза-эффект" (рис. 3), причем число мод (максимумов на кривой) определяется эффективной дозой введенного БАВ. Характерно, что наблюдается смещение по времени максимума синтеза субстрата на бифазной кривой "доза-эффект", которое зависит от эффективной дозы.
Поэтому в фармакологическом
эксперименте необходима регистрация биологических эффектов в максимально
возможном временном диапазоне: отсутствие снижение эффекта к моменту времени ![]() и его отсутствие в
момент времени
и его отсутствие в
момент времени ![]() не
означает отсутствие эффекта в момент времени
не
означает отсутствие эффекта в момент времени ![]() .
.
|
Рисунок 3. Развитие дозозависимых эффектов с течением времени.
|
Заключение
Для объяснения эффектов сверхмалых доз БАВ нет необходимости вводить понятия супервысокоаффинных рецепторов [2] или "адаптации" рецепторов [3], тем более, что наличие супервысокоафииных рецепторов и процессов рецепторной "адаптации" не доказано. Эффекты сверхмалых доз, в т.ч. полимодальные, могут быть объяснены исходя из представлений о существовании высокоэффективных систем проведения и усиления рецепторного сигнала с отрицательной обратной связью в одной или нескольких каскадных реакциях.
Список литературы
1. Sergeeva M.G., Gonchar M.V., Chistyakov V.V., Mevkh A.T. Ultra-low doses of ibuprofen activate cell prostaglandin synthesis. Appl.Biochem.Biothech., 1996; 61: 167-171.
2. Бурлакова Е.Б., Кондратов А.А., Худяков И.В. Воздействие химических агентов в сверхмалых дозах на биологические объекты. Известия АН СССР, сер.Биол., 1990; (2): 184-193.
3. Сазанов Л.А., Зайцев С.В. Действие сверхмалых доз биологически активных веществ: общие закономерности, особенности и возможные механизмы. Биохимия, 1992; 57: 1443-1460
4. Варфоломеев С.Д., Гуревич К.Г. Биокинетика. Практический курс. Москва: Фаир-Пресс; 1999. с. 85-496.
5. Рыхлецкая О.С., Шангин-Березовский Г.Н. Репродукция вируса как показатель стимулирующего действия НДММ на клетки в культуре in vitro. В: Рапопорт А.И., ред. Химический мутагенез в создании сортов с новыми свойствами. Москва:Наука; 1986. с. 210.
6. Шангин-Березовский Г.Н., Молоскин С.А., Рыхлецкая О.С. Парадоксальный эффект воздействия микродоз НДММ и ПАБК в зависимости от чувствительности подопытного материала. В: Рапопорт А.И., ред. Химический мутагенез в создании сортов с новыми свойствами. Москва:Наука; 1986. с. 243.
7. Подколозин А.А., Донцов В.И. Факторы малой интенсивности в биоактивации и иммуннокоррекции. Москва: Панас-Аэро; 1995. с. 6-191.
8. Gilles R., Gilles S., Jaenicke L. Pheromon-binding and matrixmediated events in sexual induction of Volvox carteri. Z.Nurforsch. 1984; 39: S584.
9. Sergeeva, M.G., Gonchar, M.V., Mevkh, A.T., Varfolomeev, S.D. Prostaglandin E2 biphasic control of lymphocyte proliferation: inhibition by picimolar concentration. FEBS Lett. 1997; 418: 235-238.
10. Албертис Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. Молекулярная биология клетки. Москва: Мир; 1994 (в трех томах).
11. Stephenson R.P. A modification of receptor theory. Brit. J. Pharmacol. Chemiother. 1956; 11: 379-393.
12. Гуревич К.Г., Варфоломеев С.Д. Вероятностное описание лиганд-рецепторного взаимодействия. Оценка достоверности событий с малыми и сверхмалыми дозами. I. Кинетика лиганд-рецепторного взаимодействия. Биохимия 1999; 64: 83-94.